Começando com ENTALPIA DE COMBUSTÃO:
ENTALPIA DE COMBUSTÃO:
Definindo:
Entalpia de combustão, ou calor de combustão, deve ser definida como a quantidade ou a variação de energia (entalpia) liberada quando um mol de combustível orgânico (que apresenta, obrigatoriamente, átomos de hidrogênio ligados a carbono) reage com o comburente (gás oxigênio- O2).
Os combustíveis orgânicos mais comuns utilizados em entalpias de combustão são os hidrocarbonetos, os álcoois carboidratos e os lipídeos.
CxHy + zO2 → produtos + energia (em Kcal ou KJ)
Assim, é muito comum os estudantes relacionarem a entalpia de combustão com um processo de queima, ou seja, um objeto ou líquido ardendo em chamas, como é o caso da madeira na lareira.
Por ser um fenômeno exotérmico- libera calor – , a entalpia de combustão sempre apresenta uma variação de entalpia menor que zero:
ΔH < 0
Como a variação de entalpia é dada pela diferença entre a entalpia dos produtos e a entalpia dos reagentes, podemos afirmar que, na entalpia de combustão, a entalpia dos reagentes é sempre maior que a entalpia dos produtos- (lembra que vai perder calor para o meio ambiente?) , pois:
ΔH < 0
Hp-Hr < 0
Hp < Hr
Exemplos de combustão:


Como fazer os cálculos:
Sempre será ∆H = Entalpia dos reagentes – entalpia dos produtos.
E NÃO ESQUEÇA DE BALANCEAR A REAÇÃO, OBEDECENDO A REGRA DE 1 MOL QUE VAI SER “QUEIMADO” !!! OS OUTROS ELEMENTOS PODEM RECEBER NÚMEROS ATÉ FICAR NA MESMA QUANTIDADE DOS DOIS LADOS DA EQUAÇÃO, MAS NO COMPOSTO A SER QUEIMADO, NÃO MEXE NÃO!
EXEMPLO:
C12H22O11 + 12 O2(g) → 12 CO2(g) + 11 H2O(l) Dada essa reação de combustão, calcule a variação de entalpia.
Qual é o valor da variação de entalpia dessa reação? Considere os valores das entalpias a seguir: ( veja que são dados as entalpias de formação de cada substancia e é isso que você vai usar para fazer os cálculos)
ΔH de formação do CO2(g) = -94,1 kcal
ΔH de formação de H2O(l) = -68,3 kcal
ΔH de formação do C12H22O11 = -531,5 kcal
Os dados fornecidos pelo exercício foram:
- ΔH de formação do CO2(g) = -94,1 kcal
- ΔH de formação da H2O(l) = -68,3 kcal/moll
- ΔH de formação de C12H22O11 = -531,5 kcal/mol
- ΔH de formação de C = 0 kcal/mol
OBS.: A entalpia do gás oxigênio não foi fornecida pelo enunciado porque vale zero, já que se trata do alótropo mais estável do oxigênio. Todo elemento, no seu estado natural e sendo o mais encontrado, tem entalpia ZERO.
1º Passo: Calcular o valor da entalpia dos produtos:
Hp = 12. (CO2) + 11.(H2O)
Hp = 12.(-94,1) + 11. (-68,3)
Hp = – 1129,2 – 751,3
Hp = -1880,5 Kcal
2º Passo: Calcular o valor da entalpia dos reagentes:
Hr = 1.(C12H22O11) + 12.(O2)
Hr = 1.(-531,5) + 12.0
Hr = – 531,5 Kcal
3o Passo: Utilizar as entalpias dos produtos e dos reagentes na expressão:
ΔH = Hp – Hr
ΔH = – 1880,5 – (-531,5)
ΔH = – 1349 Kcal
Como o resultado do ΔH é negativo, a reação é exotérmica.
Quando estiver bem afiado nesse processo, vamos para o cálculo da entalpia através da energia de ligação.
Aguarde!
pesquisas: HTTPS://ALUNOSONLINE.UOL.COM.BR/ ; HTTPS://WWW.MANUALDAQUIMICA.COM/
https://infoescola.com/
ENTALPIA DE FORMAÇÃO :
“A entalpia de formação, também denominada entalpia-padrão de formação, ou calor-padrão de formação, é o cálculo do calor liberado ou absorvido na formação de 1 mol de uma substância a partir de substâncias simples, no estado padrão.
É impossível calcular o valor absoluto das entalpias de cada substância, mas é possível calcular a variação da entalpia que ocorre na reação, por meio de um calorímetro.
É preciso lembrar que se convencionou adotar o valor da entalpia igual a zero para as substâncias simples no estado padrão. Dessa forma, se quisermos descobrir qual é a entalpia de formação de uma substância é só saber o valor da entalpia da reação de formação dela a partir de substâncias simples.
Por exemplo: queremos descobrir a entalpia de 18 gramas de água, que corresponde a 1 mol, pois sua massa molar é de 18 g /mol. Para tal, precisamos primeiro da reação de formação da água a partir de substâncias simples, conforme mostrado abaixo:
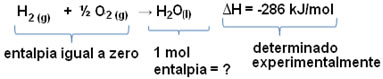
Observe que o valor da variação da entalpia que houve nessa reação foi determinado experimentalmente por meio de um calorímetro e é igual a -286 kJ/mol.
A fórmula que calcula essa variação de entalpia (ΔH) é:
ΔH = HProdutos – HReagentes
Assim, visto que já sabemos o valor de ΔH e que a entalpia dos reagentes é igual a zero (pois são substâncias simples no estado padrão), podemos, então, concluir que o valor da entalpia de 1 mol de água é igual à variação de entalpia da reação de formação, já que ela é o único produto dessa reação, conforme mostrado abaixo:
ΔH = HProdutos – HReagentes
-286 kJ/mol = HH2O – (HH2 + H1/2 O2)
-286 kJ/mol = HH2O – 0″
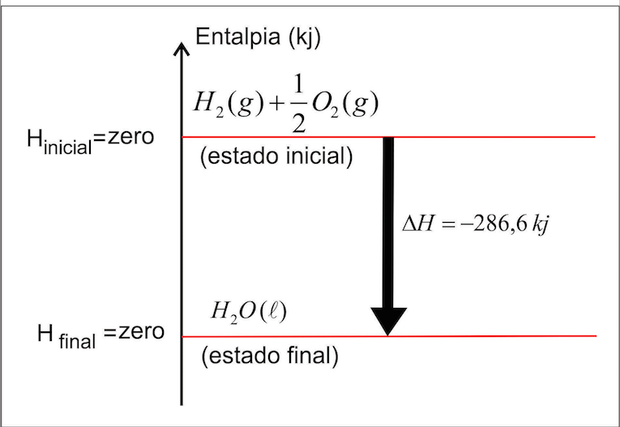
GRAFICAMENTE:
texto : https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm

