CONCEITOS FUNDAMENTAIS
Entalpia é a energia térmica envolvida nos diferentes tipos de reações químicas, em que as substâncias simples têm, por convenção, entalpia igual a zero. A variação da entalpia pode ser calculada pela subtração do valor de entalpia dos produtos pelo valor de entalpia dos reagentes, ou seja:
∆H = Hp – Hr
∆H → Variação de entalpia
Hp → Entalpia dos produtos
Hr → Entalpia dos reagentes
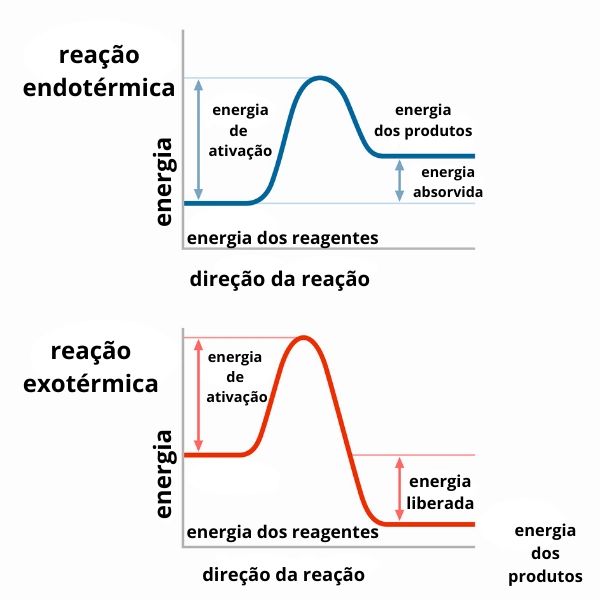
O resultado do cálculo de variação de entalpia determinará se estamos lidando com uma reação que libera ou absorve calor, como pode ser observado nos gráficos a seguir:
Nota: Energia de ativação é a energia necessária para que a reação se inicie.
Na reação endotérmica a energia final dos produtos É MAIOR QUE A ENERGIA INICIAL DOIS REAGENTES. Isso ocorre porque há um GANHO DE ENERGIA = ENERGIA ABSORVIDA. NESSE CASO O ∆H É POSITIVO.
Na reação exotérmica, a energia final dos produtos É MENOR QUE A ENERGIA INICIAL DOS REAGENTES. Isso ocorre porque há uma PERDA DE ENERGIA = ENERGIA LIBERADA. NESSE CASO O ∆H É NEGATIVO.
Tipos de entalpia
-
Entalpia de formação
É a variação de energia térmica envolvida na formação de um mol de uma substância qualquer, sendo ela formada com base em substâncias simples ou no estado fundamental, como no exemplo a seguir:
1/2H2 + O2 = H2O
→ Note que os reagentes são ambos substâncias simples, ou seja, têm entalpia igual a 0, e que o valor de entalpia da água (H2O) é predeterminado em laboratório, sendo, portanto, um dado fornecido, logo, o calculo da variação de entalpia fica da seguinte forma:
∆H = Hp – Hr
∆H = ( – 68,4 ) – (1/2.0 + 0)
∆H = -68,4 → Reação exotérmica PORQUE LIBEROU ENERGIA
→ Perceba que temos um resultado menor que 0, isso significa que, nessa reação de formação de um mol de H2O, teremos liberação de energia.
-
Entalpia de combustão
É a variação aferida de calor para que haja a combustão de 1 mol de uma substância qualquer. Toda reação de combustão terá valor de variação de entalpia menor que zero, pois se trata de uma reação que libera calor.
- Exemplo
Reação e valor da variação de entalpia para a reação de combustão do etanol:
C2H6O(l) + 3.O2(g) → 2 CO2(g) + 3 H2O(l) ΔH = -326 Kcal/mol
A seguir, valores de entalpia de combustão para algumas substâncias comuns:
- Etanol gasoso (C2H6)= -372,8 Kcal/mol
- Benzeno líquido (C6H6) = -781,0 Kcal/mol
- Sacarose sólida ( C12 H22O 11) = -1348,9 Kcal/mol
-
Entalpia de ligação
É a energia necessária para romper-se um mol de uma ligação química. A variação de energia nesse caso sempre resulta em um valor maior que 0, ou seja, a quebra de ligações demanda absorção de calor.
- Exemplo
CH4(g)+C(g)+4H(g) ΔH = +1.651,6 kJ/mol
C – H → C(g) + H(g) ΔH = +412,9 KJ/ mol
Cl – Cl → Cl(g) + Cl (g) ΔH = +242,0 KJ/mol
Sempre que se rompe ligações, há absorção de energia. E quando as ligações são realizadas, há liberação de energia.
Os vídeos abaixo também vão ajudar:
Os vídeos fazem parte do CANAL XQUIMICA
pesquisa: https://mundoeducacao.uol.com.br/quimica/

